臨床成績

試験概要
「注意事項等情報」等は最新の電子添文をご参照ください。
本剤は、国際共同第Ⅱ/Ⅲ相臨床試験に基づき承認されました。
一部承認外の用法及び用量による成績が含まれますが、承認時評価資料のため紹介します。
*1:
日本人集団は主試験終了後、16週間の追加投与期間を含む52週間
*2:
国内の承認用法及び用量は、「7歳以上の患者には、通常、1回体重1kg当たり10~30国際単位を投与するが、患者の状態に応じて適宜増減する。定期的に投与する場合、12歳以上の患者には、通常、体重1kg当たり30~40国際単位を週2回投与するが、患者の状態に応じて、体重1kg当たり45~60国際単位を5日に1回投与、又は体重1kg当たり60国際単位を週1回投与することもできる。(一部抜粋)」とされている。
*3:
4人の患者が最初の10週間の間に治験薬の投与を中止(副作用1例、同意撤回3例)
*4:
週1回群及び5日ごと群において、許容範囲を超えた出血頻度の増加が起きた場合、試験を中止することが可能であった。また、オプションとして投与頻度を1回だけ変更をすることを可能とし、変更後の患者データは、救済群として扱った。
*5:
算術平均、標準偏差(SD)及び変動係数(CV)、幾何平均、幾何SD及びCV、最小値、中央値、最大値、評価例数
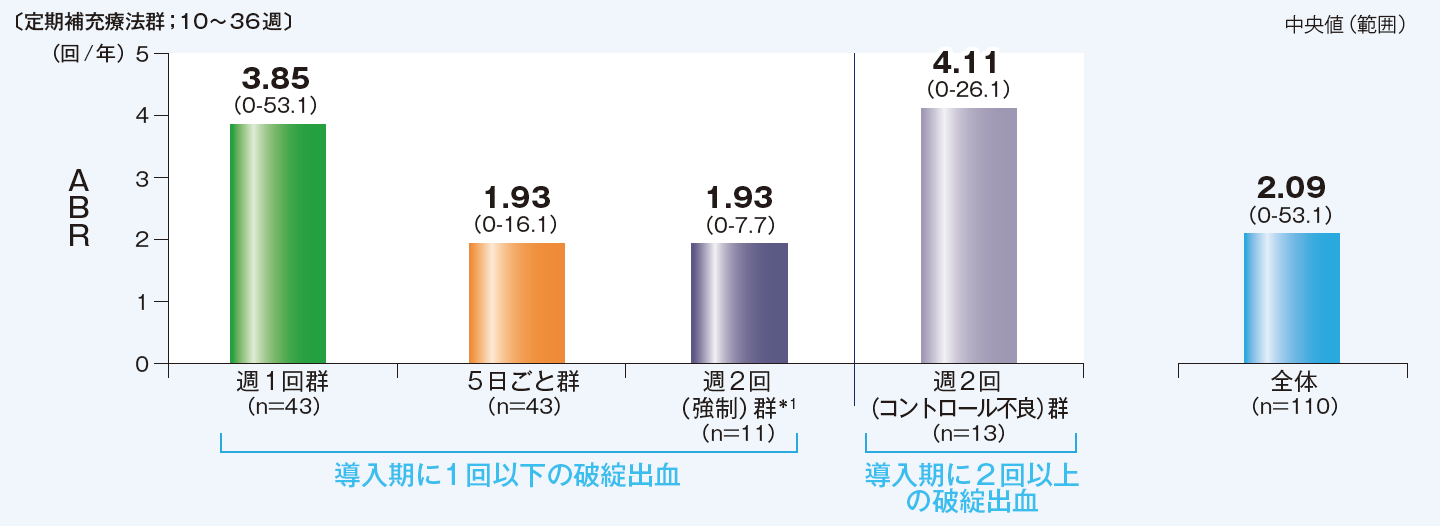
【サブグループ解析】週1回群及び週1回群のうち、週1回投与を継続できた患者の全出血の推定年間出血率(ABR)、出血しなかった患者の割合
本解析は事後解析ですが、有効性の根拠とされた承認時評価資料であり、臨床的に重要なデータであるため紹介します。
週1回群のうち、週1回投与を継続できた32例におけるABR中央値は0.96回/年、出血しなかった患者の割合は50%でした。
10~36週のデータ
*:
投与頻度変更を行わず、週1回投与を継続できた群。本試験では週1回群及び5日ごと群において、許容範囲を超えた出血頻度の増加が起きた場合、規定量まで増量が可能であり、それでも出血コントロールが不十分な場合は、試験を中止又は投与頻度を1回だけ変更をすることが可能であった。
【主要評価項目】全出血の推定年間出血率(ABR)
【副次評価項目】出血の種類別ABR
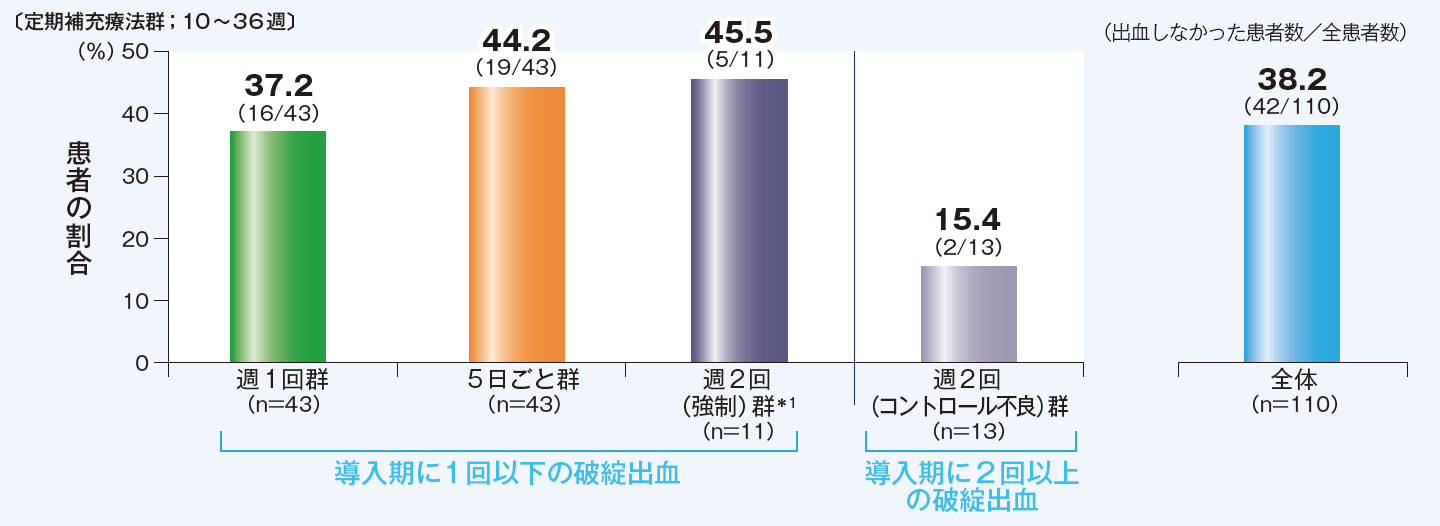
【その他の評価項目】出血しなかった患者の割合
週2回群のうち、導入期に破綻出血が1回以下であった週2回強制群のABR中央値は1.93回/年でした。導入期に破綻出血が2回以上であったコントロール不良群のABR中央値は4.11回/年でした。
10~36週のデータ 破綻出血の定義:(自然発生で外傷を認めない)関節内または筋肉内出血
*1:
週2回(強制)群 n=11(週1回群及び5日ごと群が割付上限に達したため無作為化されず、週2回投与を継続した症例)
*2:
週2回(コントロール不良)群 n=13
*3:
導入期(0~10週)ABR中央値は、0回/年(範囲:0-10.4)
*4:
導入期(0~10週)ABR中央値は、17.40回/年(範囲:9.9-30.0)
幾何平均値(%CV)
合成基質法
t1/2:消失半減期、AUC:投与0時間から無限大時間までのFⅧ活性-時間曲線下面積、CL:クリアランス
【試験13401: 試験方法】
治療歴のある18~65歳の重症血友病A患者(FⅧ活性:1%未満)14例(低用量群及び高用量群:各7例)に、オクトコグ アルファを単回静脈内投与(低用量群では25 IU/kg、高用量群では50 IU/kg)、並びに3日以上の休薬期間後にジビイを静脈内投与[単回(初回)投与(低用量群では25 IU/kg、高用量群では60 IU/kg*)、及び単回投与7日後から8週間反復投与(低用量群では週2回25 IU/kg*、高用量群では週1回60 IU/kg)]し、血漿中FⅧ活性の推移を検討した。血液検体は単回(初回)投与時及び反復投与時の最終投与時における投与前並びに投与終了0.25、0.5、1、3、6、8、24、48、72、96~144、168時間後に採取し(オクトコグ アルファは投与後48時間まで)、合成基質法及び凝固一段法にて測定した。1回あたり投与量が同じである低用量群のデータを紹介する。
*:
国内の承認用法及び用量は、「7歳以上の患者には、通常、1回体重1kg当たり10~30国際単位を投与するが、患者の状態に応じて適宜増減する。定期的に投与する場合、12歳以上の患者には、通常、体重1kg当たり30~40国際単位を週2回投与するが、患者の状態に応じて、体重1kg当たり45~60国際単位を5日に1回投与、又は体重1kg当たり60国際単位を週1回投与することもできる。(一部抜粋)」とされている。

副作用
- 安全性評価対象134例のうち、副作用(臨床検査値異常を含む)は12例(9.0%、出血時補充療法群:1例、定期補充療法群:11例)に認められました。
- 主な副作用は頭痛2例(1.5%)でした。
- 重篤な副作用は2例(1.5%)(薬物過敏症、過量投与*1各1例)に認められました。
- 投与中止に至った副作用は2例(1.5%)(過敏症、薬物過敏症 各1例)に認められました。
- 死亡例は報告されませんでした。
免疫原性
- FⅧインヒビターの発現:認められませんでした。
- 抗ジビイ抗体*2の産生:本剤投与中に5例で認められました。
- 抗PEG抗体*3の産生:本剤投与中に7例で認められました(うち5例は抗ジビイ抗体と重複)。
- 3例は本剤投与開始から4曝露日以内でした。
- 1例で4曝露日以内に抗PEG抗体との関連が疑われる過敏症が認められましたが、その他の6例は有害事象又は有効性の欠如とは関連しませんでした。
- 抗BHK/HCP抗体*4の産生:
- 試験終了時点において5 例で抗BHK/HCP抗体が陽性と判定されました。
- 4例は投与開始前の検体が陽性と判定されており、このうち3例は、投与終了時の抗BHK/HCP抗体の抗体価が、投与開始前と比べて低下していました。
- 他の1例は、投与開始前は陰性で、試験終了時に陽性と判定されましたが、抗BHK/HCP抗体の抗体価は低く、また抗BHK/HCP抗体に関連する有害事象は認められませんでした。
- PEGの定量:PEGの蓄積を示す結果は得られませんでした。
*1:
過量投与に関連した症状は報告されていない
*2:
抗ポリエチレングリコールBドメイン欠失遺伝子組換え血液第Ⅷ因子抗体(抗PEG-BDD-rFⅧ抗体)。ジビイに対する抗体
*3:
ポリエチレングリコールに対する抗体
*4:
ジビイ製造の際に使用するベビーハムスター腎細胞(BHK細胞)又は宿主細胞由来タンパク質(HCP)に対する抗体
1)
バイエル薬品社内資料[日本人を含む治療歴のある12歳以上の重症血友病A患者を対象とした国際共同第Ⅱ/Ⅲ相臨床試験
(PROTECT Ⅷ主試験)](承認時評価資料)
2)
バイエル薬品社内資料[治療歴のある重症血友病A患者を対象として薬物動態を検討した海外第Ⅰ相臨床試験](承認時評価資料)
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、緩徐に静脈内注射する。なお、1分間に2.5mLを超える注射速度は避けること。
7歳以上の患者には、通常、1回体重1kg当たり10~30国際単位を投与するが、患者の状態に応じて適宜増減する。
定期的に投与する場合、12歳以上の患者には、通常、体重1kg当たり30~40国際単位を週2回投与するが、患者の状態に応じて、体重1kg当たり45~60国際単位を5日に1回投与、又は体重1kg当たり60国際単位を週1回投与することもできる。7歳以上12歳未満の小児には、通常、体重1kg当たり40~60国際単位を週2回投与する。
8. 重要な基本的注意(抜粋)
8.2 患者の血中に血液凝固第Ⅷ因子に対するインヒビターが発生するおそれがある。特に、血液凝固第Ⅷ因子製剤による補充療法開始後、投与回数が少ない時期(補充療法開始後の比較的早期)や短期間に集中して補充療法を受けた時期にインヒビターが発生しやすいことが知られている。本剤を投与しても予想した止血効果が得られない場合には、インヒビターの発生を疑い、回収率やインヒビターの検査を行うなど注意深く対応し、適切な処置を行うこと。
8.4 本剤の臨床試験において、抗ポリエチレングリコール(PEG)抗体との関連が疑われる過敏症又は有効性の欠如が報告されている。いずれも本剤投与開始初期に認められていることから、本剤投与開始初期には観察を十分に行うこと。本剤を投与しても予想した止血効果が得られない場合には、回収率やインヒビターの検査を行うなど注意深く対応し、有効性の欠如が疑われたときには、過去の治療で有効であった血液凝固第Ⅷ因子製剤に切り替えるなど、適切な処置を行うこと。[15.1.2 参照]